El calor específico es un parámetro que depende del material y relaciona el calor que se proporciona a una masa determinada de una sustancia con el incremento de temperatura:
- Q es el calor aportado al sistema.
- m es la masa del sistema.
- c es el calor específico del sistema.
- ΔT es el incremento de temperatura que experimenta el sistema.
- [c] =

- [c] =

 =
= ![1 \left [ \frac{cal}{gC} \right ]](http://upload.wikimedia.org/math/d/5/a/d5aed3d8d24445d83da6d3f8a081430f.png)
Calor específico molar
El calor específico de una sustancia es un índice importante de su constitución molecular interna, y a menudo da información valiosa de los detalles de su ordenación molecular y de las fuerzas intermoleculares. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:Capacidad calorífica
La capacidad calorífica de una sustancia es una magnitud que indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Se denota por C y se define como:- C =
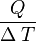
![\left [ \frac{J}{K} \right ]](http://upload.wikimedia.org/math/2/8/a/28a965e43a814809c9426baece39a88c.png)
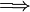 C = mc
C = mcDe igual forma se puede definir la capacidad calórica molar como:
- Cn = nc
Cambios de fase
En la naturaleza existen tres estados usuales de la materia: sólido, líquido y gaseoso. Al aplicarle calor a una sustancia, ésta puede cambiar de un estado a otro. A estos procesos se les conoce como cambios de fase. Los posibles cambios de fase son:-
- de estado sólido a líquido, llamado fusión,
- de estado líquido a sólido, llamado solidificación,
- de estado líquido a gaseoso, llamado evaporación o vaporización,
- de estado gaseoso a líquido, llamado condensación,
- de estado sólido a gaseoso, llamado sublimación progresiva,
- de estado gaseoso a sólido, llamado sublimación regresiva o deposición,
- de estado gaseoso a plasma, llamado ionización.


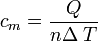



No hay comentarios:
Publicar un comentario